電流源是在閉合電路中產生電流的裝置。目前,已經發明了大量類型的此類源。每種類型都用於特定目的。
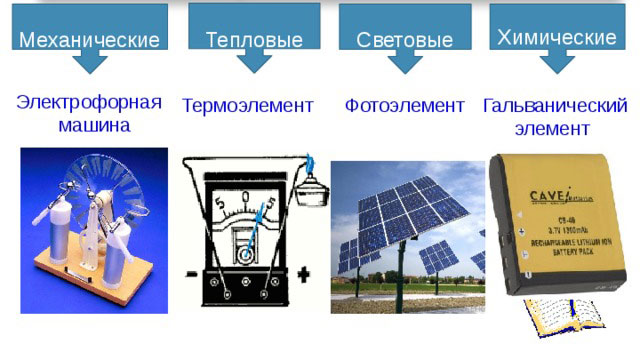
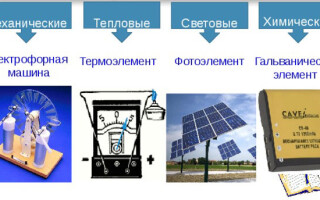
電流源的類型
有以下類型的電流源:
- 機械的;
- 熱的;
- 光;
- 化學。
機械源
這些能源將機械能轉化為電能。轉換是在特殊設備 - 發電機中進行的。主要發電機是渦輪發電機,電機由氣體或蒸汽流驅動,水力發電機將落水的能量轉化為電能。地球上的大部分電力都是由機械轉換器精確產生的。

熱源
在這裡,熱能轉化為電能。電流的發生是由於兩對接觸的金屬或半導體(熱電偶)之間的溫差。在這種情況下,帶電粒子從加熱區域轉移到冷區域。電流的大小直接取決於溫差:溫差越大,電流越大。基於半導體的熱電偶提供的熱電功率是雙金屬熱電偶的 1000 倍,因此可以用它們製成電流源。金屬熱電偶僅用於測量溫度。

參考! 要獲得熱電偶,您需要連接 2 種不同的金屬。
目前,基於放射性同位素自然衰變過程中釋放的熱量的轉換,已經開發出新的元素。這種元素被稱為放射性同位素熱電發生器。在航天器中,使用钚 238 同位素的發電機已經證明自己很好。它在 30 V 的電壓下提供 470 W 的功率。由於這種同位素的半衰期為 87.7 年,因此發生器的壽命非常長。雙金屬熱電偶用於將熱量轉化為電能。
光源
隨著20世紀末半導體物理學的發展,出現了新的電流源——太陽能電池,將光能轉化為電能。它們利用半導體的特性在暴露於光通量時產生電壓。這種效應在矽半導體中尤其強烈。但是,這些元件的效率仍然不超過 15%。太陽能電池板已成為航天工業中不可或缺的一部分,並已開始應用於日常生活中。這種電源的價格不斷下降,但仍然很高:每 1 瓦功率約 100 盧布。

化學來源
所有化學來源可分為 3 組:
- 電偶
- 電池
- 熱的
原電池的工作原理是放置在電解質中的兩種不同金屬的相互作用。各種化學元素及其化合物可以作為金屬對和電解質。元素的類型和特性取決於此。
重要的! 原電池僅使用一次,即一旦出院,就無法恢復。
有 3 種類型的電流源(或電池):
- 鹽;
- 鹼性;
- 鋰。
鹽或其他“幹”電池使用來自金屬鹽的糊狀電解質,放置在鋅杯中。陰極是位於杯子中心的石墨-錳棒。這種電池的廉價材料和易於製造使它們成為所有電池中最便宜的。但就特性而言,它們明顯不如鹼性電池和鋰電池。

鹼性電池使用糊狀的鹼溶液氫氧化鉀作為電解質。鋅陽極被鋅粉取代,這使得增加元件的電流輸出和操作時間成為可能。這些元素的服務時間是鹽元素的 1.5 倍。
在鋰電池中,陽極由鹼金屬鋰製成,這大大增加了運行時間。但與此同時,由於鋰的成本相對較高,價格有所上漲。此外,鋰電池可能具有不同的電壓,具體取決於正極材料。他們生產電壓為 1.5 V 至 3.7 V 的電池。
電池是可以經受許多充電-放電循環的電流源。電池的主要類型有:
- 鉛酸;
- 鋰離子;
- 鎳鎘。
鉛酸電池由浸入硫酸溶液中的鉛板組成。當外部電路閉合時,會發生化學反應,結果鉛在陰極和陽極轉化為硫酸鉛,並形成水。在充電過程中,硫酸鉛在陽極被還原為鉛,在陰極被還原為二氧化鉛。

參考! 鉛鋅電池的一個元件產生 2 V 的電壓。通過串聯元件,您可以獲得 2 的倍數的任何電壓。例如,在汽車電池中,電壓為 12 V,因為。連接 6 個元素。
鋰離子電池因鋰離子在電解液中作為電的載體而得名。離子源自陰極,陰極由鋁箔基材上的鋰鹽製成。陽極由各種材料製成:石墨、氧化鈷和銅箔基材上的其他化合物。
電壓取決於所使用的組件,可以從 3 V 到 4.2 V。由於自放電率低和充放電循環次數多,鋰離子電池在家用電器中非常受歡迎。
重要的! 鋰離子電池對過度充電非常敏感。因此,要為它們充電,您需要使用專為它們設計的充電器,這些充電器具有內置的特殊電路,可防止過度充電。否則,電池可能會被損壞和點燃。

在鎳鎘電池中,陰極由鎳鹽在鋼網上製成,陽極由鎘鹽在鋼網上製成,電解液是氫氧化鋰和氫氧化鉀的混合物。這種電池的標稱電壓為 1.37 V。它可以承受 100 到 900 次充放電循環。
參考! 與鋰離子電池不同,鎳鎘電池可以在放電狀態下儲存。
熱化學元件用作備用電源。它們在比電流密度方面具有出色的特性,但使用壽命短(長達 1 小時)。它們主要用於火箭技術,需要可靠性和短期運行。
重要的! 最初,熱化學源不能產生電流。其中,電解質以固態形式包含,為了使電池進入工作狀態,需要加熱到 500-600°C。這種加熱是通過一種特殊的煙火混合物進行的,該混合物在適當的時間點燃。
真實來源與理想來源的區別
根據物理定律,理想的電源必須具有無限大的內阻,以確保負載中的電流恆定。實際電源具有有限的內阻,這意味著電流取決於外部負載和內阻。
以下是對各種現代電流源的簡要總結。從評論中可以看出,迄今為止,已經創建了大量具有適用於任何應用程序的特性的源。
類似文章: